Estudo identifica células-tronco que dão origem a novos ossos e cartilagens em humanos
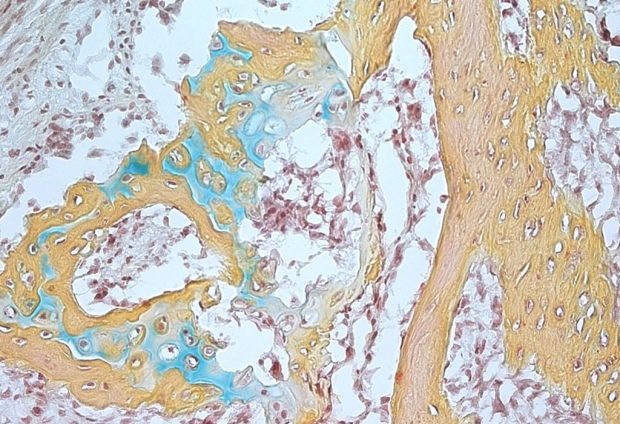
Uma pequena estrutura óssea que surge da célula-tronco esquelética humana contém cartilagem (azul), medula óssea (marrom) e osso (amarelo). Cortesia dos laboratórios Longaker e Chan
A identificação da célula-tronco esquelética humana pelos cientistas de Stanford pode abrir caminho para tratamentos regenerativos para fraturas ósseas, artrite e lesões articulares.
Um esforço de uma década conduzido por cientistas da Faculdade de Medicina da Universidade de Stanford foi recompensado com a identificação da célula-tronco esquelética humana.
A célula, que pode ser isolada do osso humano ou gerada a partir de células especializadas na gordura, dá origem a células progenitoras que podem produzir osso novo, o estroma esponjoso do interior do osso e a cartilagem que ajuda os joelhos e outras articulações a funcionar suavemente e indolor.

Cortesia dos laboratórios Longaker e Chan
A descoberta permitiu aos pesquisadores criar um tipo de árvore genealógica de células-tronco importante para o desenvolvimento e manutenção do esqueleto humano. Também pode abrir caminho para tratamentos que regeneram ossos e cartilagens em pessoas.
“Todos os dias, crianças e adultos precisam de osso normal, cartilagem e tecido estromal”, disse Michael Longaker, MD, professor de cirurgia plástica e reconstrutiva. “Há 75 milhões de americanos com artrite, por exemplo. Imagine se pudéssemos transformar as células de gordura prontamente disponíveis da lipoaspiração em células-tronco que poderiam ser injetadas em suas articulações para fazer novas cartilagens, ou se pudéssemos estimular a formação de novos ossos para reparar fraturas em pessoas mais velhas ”.
Um artigo descrevendo a descoberta foi publicado online em 20 de setembro pela Cell.
Longaker, o Professor Deane P. e Louise Mitchell na Escola de Medicina e co-diretor do Instituto Stanford para Biologia de Células-Tronco e Medicina Regenerativa, é o autor sênior. Os autores principais são Charles K.F. Chan, PhD, professor assistente de cirurgia; estudante de medicina Gunsagar Gulati, MD; Rahul Sinha, PhD, instrutor de biologia de células-tronco e medicina regenerativa; e assistente de pesquisa Justin Vincent Tompkins.
“Verdadeiro, multipotencial, auto-renovável”
As células-tronco esqueléticas são distintas de outro tipo de célula chamada de célula-tronco mesenquimal, que pode gerar tecidos esqueléticos, gordura e músculo. As células-tronco mesenquimais, que podem ser isoladas do sangue, da medula óssea ou da gordura, são consideradas, por alguns médicos, como células-tronco genéricas. Eles foram testados, com sucesso limitado, em ensaios clínicos e como tratamentos experimentais não comprovados para sua capacidade de regenerar uma variedade de tecidos. Recentemente, três pacientes idosos na Flórida foram cegados ou perderam a visão depois que as células-tronco mesenquimais da gordura foram injetadas em seus olhos como um tratamento experimental para a degeneração macular.
“As células-tronco mesenquimais são vagamente caracterizadas e provavelmente incluem muitas populações de células, cada uma das quais pode responder de maneira diferente e imprevisível a sinais de diferenciação”, disse Chan. “Em contraste, a célula-tronco esquelética que identificamos possui todas as qualidades marcantes de células-tronco verdadeiras, multipotenciais, auto-renováveis e específicas para tecidos. Eles são restritos em termos de seu potencial de destino apenas aos tecidos esqueléticos, o que provavelmente os tornará muito mais úteis clinicamente ”.
A regeneração do esqueleto é uma capacidade importante para qualquer animal ósseo que evolua em um mundo desordenado, onde apenas os mais aptos, ou os de cura mais rápida, provavelmente sobreviverão por muito tempo até a idade adulta. Alguns vertebrados, como os novatos, são capazes de regenerar membros inteiros, se necessário, mas a capacidade de cura de outros animais, como ratos e humanos, é mais modesta. Embora os humanos possam curar uma fratura óssea razoavelmente bem, eles começam a perder parte dessa habilidade com a idade. E eles são completamente incapazes de regenerar a cartilagem que se desgasta com a idade ou o uso repetitivo. Os pesquisadores se perguntaram se a célula-tronco esquelética poderia ser usada clinicamente para ajudar a substituir ossos ou cartilagens danificados ou ausentes, mas tem sido muito difícil de identificar.
Células-tronco adultas restritas à linhagem
Ao contrário das células-tronco embrionárias, que estão presentes apenas nos primeiros estágios de desenvolvimento, acredita-se que as células-tronco adultas sejam encontradas em todos os principais tipos de tecidos, onde aguardam o tempo necessário para reparar danos ou traumas. Cada célula-tronco adulta é restrita à linhagem – isto é, produz células progenitoras que dão origem apenas aos tipos de células que ocorrem naturalmente nesse tecido. Para o nosso esqueleto, isso significa células que fazem osso, cartilagem e estroma.
Chan, Longaker e seus colegas esperavam usar o que aprenderam, identificando a célula-tronco esquelética de rato para isolar rapidamente sua contraparte humana. Mas a busca acabou sendo mais difícil do que eles previam. A maioria dos esforços de isolamento celular se concentra no uso de uma tecnologia chamada triagem de células ativadas por fluorescência para separar células com base na expressão de proteínas em sua superfície. Freqüentemente, tipos de células similares de diferentes espécies compartilham alguns marcadores chave da superfície celular.
Mas a célula-tronco esquelética humana acabou por compartilhar alguns marcadores com o mouse. Em vez disso, os pesquisadores tiveram que comparar os perfis de expressão gênica da célula-tronco esquelética de camundongo com os de vários tipos de células humanas encontradas nas extremidades crescentes do desenvolvimento do osso humano. Ao fazê-lo, eles foram capazes de identificar uma população de células que produziu muitas das mesmas proteínas que a célula-tronco esquelética do rato. Eles então retrocederam para identificar marcadores na superfície das células humanas que poderiam ser usados para isolá-los e estudá-los como uma população pura.
“Este foi um desafio bastante bioinformática, e exigiu uma grande equipe de pesquisadores interdisciplinares, mas, eventualmente, Chuck e seus colegas foram capazes de identificar uma série de marcadores que sentimos que tinham um grande potencial”, disse Longaker. “Então eles tiveram que provar duas coisas: essas células podem se auto-renovar, ou fazer mais por si mesmas indefinidamente, e elas podem fazer as três principais linhagens que compõem o esqueleto humano?”
Os pesquisadores mostraram que as células-tronco esqueléticas humanas que eles identificaram são auto-renováveis e capazes de produzir ossos, cartilagens e progenitores de estroma. Encontra-se no final do desenvolvimento do osso, bem como em números aumentados perto do local de cicatrização das fraturas. Não só pode ser isolado de locais de fratura, mas também pode ser gerado pela reprogramação de células de gordura humanas ou células-tronco pluripotentes induzidas para assumir um destino esquelético.
“O nicho perfeito”
Curiosamente, a célula-tronco esquelética também forneceu um ambiente estimulante para o crescimento de células-tronco hematopoiéticas humanas – ou as células em nossa medula óssea que dão origem ao nosso sangue e sistema imunológico – sem a necessidade de fatores de crescimento adicionais encontrados no soro.
“Células-tronco formadoras de sangue amam o interior do osso esponjoso”, disse Chan. “É o nicho perfeito para eles. Descobrimos que a população estromal que surge da célula-tronco esquelética pode manter as células-tronco hematopoiéticas vivas por duas semanas sem soro. ”
Ao estudar o potencial de diferenciação da célula-tronco esquelética humana, os pesquisadores foram capazes de construir uma árvore genealógica de células-tronco para servir de base para futuros estudos sobre potenciais aplicações clínicas. Compreender as semelhanças e diferenças entre as células-tronco esqueléticas de ratos e humanos também pode desvendar mistérios sobre a formação esquelética e propriedades intrínsecas que diferenciam esqueletos de ratos e humanos.
“Agora podemos começar a entender por que o osso humano é mais denso que o dos ratos, ou por que os ossos humanos se tornam muito maiores”, disse Longaker.
Em particular, os pesquisadores descobriram que a célula-tronco esquelética humana expressa genes ativos na via de sinalização Wnt conhecida por modular a formação óssea, enquanto que a célula-tronco esquelética de camundongo não.
O objetivo final dos pesquisadores, no entanto, é encontrar uma maneira de usar a célula-tronco esquelética humana na clínica. Longaker prevê um futuro no qual a artroscopia – um procedimento minimamente invasivo no qual uma pequena câmera ou instrumentos cirúrgicos, ou ambos, são inseridos em uma articulação para visualizar e tratar cartilagem danificada – poderia incluir a injeção de uma célula-tronco esquelética especificamente restrita para gerar novas cartilagem, por exemplo.
“Espero que, dentro da próxima década, essa fonte celular seja um divisor de águas no campo da medicina artroscópica e regenerativa”, disse Longaker. “Os Estados Unidos têm uma população em rápido envelhecimento que sofre quase dois milhões de substituições de juntas a cada ano. Se pudermos usar essa célula-tronco para terapias relativamente não-invasivas, pode ser um sonho realizado. ”
Longaker é membro do Stanford Child Health Research Institute, do Stanford Cardiovascular Institute, do Stanford Cancer Institute e da Stanford Bio-X.
Outros autores de Stanford são os estudiosos da CIRM Michael Lopez, Rachel Brewer e Lauren Koepke; ex-alunos de pós-graduação Ava Carter, PhD e Ryan Ransom; os alunos de pós-graduação Anoop Manjunath e Stephanie Conley; ex-aluno de pós-doutorado Andreas Reinisch, MD, PhD; assistente de pesquisa Taylor Wearda; professor assistente clínico de cirurgia plástica e reconstrutiva Matthew Murphy, MD; estudante de medicina Owen Marecic; ex-pesquisadora de ciências da vida Eun Young Seo; o ex-assistente de pesquisa Tripp Leavitt, MD; assistentes de pesquisa Allison Nguyen, Ankit Salhotra, Taylor Siebel e Karen M Chan; instrutor de biologia de células-tronco e medicina regenerativa Wan-Jin Lu, PhD; os acadêmicos de pós-doutorado Thomas Ambrosi, PhD, e Mimi Borrelli, MD; residente de cirurgia ortopédica Henry Goodnough, MD, PhD; professor assistente de cirurgia ortopédica Julius Bishop, MD; professor de cirurgia ortopédica Michael Gardner, MD; professor de medicina Ravindra Majeti, MD, PhD; professor associado de cirurgia Derrick Wan, MD; professor de cirurgia Stuart Goodman, MD, PhD; professor de patologia e de biologia do desenvolvimento Irving Weissman, MD; e professor de dermatologia e genética Howard Chang, MD, PhD.
Pesquisadores da Universidade de Medicina de Graz, na Áustria, RIKEN, no Japão, e da Universidade da Califórnia, em San Diego, também contribuíram para o estudo.
O estudo foi financiado pelos Institutos Nacionais de Saúde (subvenções R01DE027323, R56DE025597, R01DE026730, R01DE021683, R21DE024230, U01HL099776, U24DE026914, R21DE019274, U01HL099999, R01CA86065, R01HL058770, NIAK99AG049958, P50HG007735, R01R055650, R01AR06371 e S10 RR02933801). para a Medicina Regenerativa, o Instituto Médico Howard Hughes, a Oak Foundation, o Hagey Laboratory, o Pitch Johnson Fund, o Gunn / Oliver Research Fund, uma Siebel Fellowship, um PCFYI Award, Stinehart / Reed, a Deutsche Forschungsgemeinschaft e a Ellenburg Chair.
Os pesquisadores têm uma patente pendente para o isolamento, derivação e uso de células-tronco esqueléticas humanas e seus progenitores a jusante.
O Departamento de Cirurgia de Stanford também apoiou o trabalho.
Con informações da Universidade de Stanford.













